Entendendo a circovirose suína
O circovírus suíno é um vírus de DNA circular, fita simples, não envelopado, pertencente à família Circoviridae. São vírus estáveis no ambiente, e extremamente resistentes a desinfetantes. Já foram descritos o Circovírus suíno tipo 1 (PCV1), Circovírus Suíno tipo 2 (PCV2) e recentemente o Circovírus suíno tipo 3 (PCV3). O PCV1 foi identificado como contaminante comum de células de cultivo de rim, e não é considerado patogênico para suínos. O PCV2 por sua vez, é o agente responsável pela circovirose suína, diagnosticada pela primeira vez no Brasil no ano de 2000, e que até os dias de hoje segue sendo uma enfermidade que causa impacto econômico relevante na suinocultura mundial.
O PCV2 é classificado em cinco diferentes genótipos (A-E), sendo esta variabilidade resultado dos mecanismos de evolução do PCV2, que incluem mutação e recombinação genética. Nos primeiros anos de identificação da circovirose suína, os genótipos prevalentes eram o PCV2a, seguido do PCV2b. Em contrapartida, nos últimos anos houve uma mudança na distribuição dos genótipos nas granjas brasileiras, com maior prevalência do PCV2d (antigamente descrito como PCV2b mutante) e PCV2b.
A primeira identificação do PCV3 em suínos ocorreu em 2015, por análise de metagenômica. Contudo, estudos retrospectivos demonstram a presença do agente desde 1990. Pesquisa conduzida na Alemanha verificou por análise filogenética dois grupos de PCV3, que podem ser considerados genótipos diferentes. O agente já foi identificado em órgãos de animais que apresentavam falha reprodutiva, síndrome dermatite e nefropatia suína, tremor congênito, miocardite e vasculite. No Brasil o vírus está circulando em várias regiões e está sendo identificado em porcas com falha reprodutiva, causando abortos, natimortos e fetos mumificados.
Principais causas e sintomas da doença
A circovirose suína apresenta diferentes manifestações clínicas, a mais importante é a Síndrome Multissistêmica do Definhamento Suíno (SMDS), que acomete leitões entre 5 a 12 semanas de idade. A morbidade e a mortalidade podem chegar até 70-80%, respectivamente. Os animais que não morrem, acabam perdendo peso progressivamente (refugando), sem capacidade de recuperação.
Outras formas de apresentação da doença incluem problemas respiratórios, enterites, dermatite e nefropatia, além de falhas reprodutivas (mumificados, natimortos, nascimento de leitegadas fracas, e em menor frequência abortos). O PCV2 atua causando apoptose em células em divisão, principalmente macrófagos e linfócitos B. Resultando em imunossupressão por afetar o tecido linfóide e consequentemente é considerado um importante agente de co-infecções, agravando o quadro clínico quando associado a outros patógenos, como por exemplo, o vírus da Influenza suína e Mycoplasma hyopneumoniae.
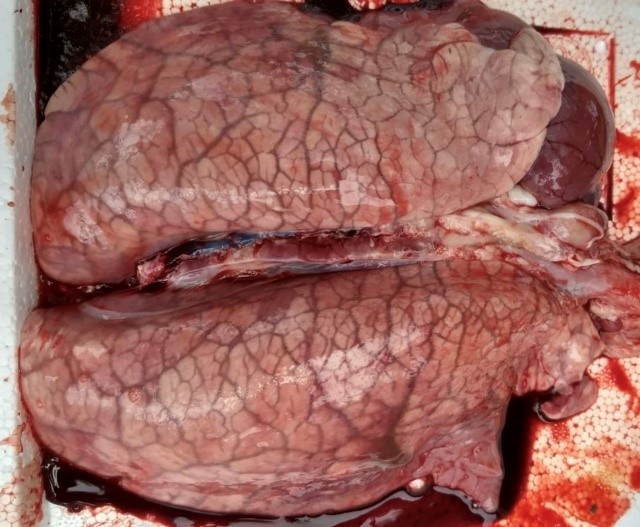
Fonte: acervo do autor
Após o início da utilização das vacinas, houve uma diminuição da ocorrência e gravidade dos quadros clínicos, e a principal forma de apresentação da doença passou a ser a subclínica. Nestes casos a granja passa a apresentar desempenho insuficiente, com demora no ganho de peso, aumento da frequência e severidade dos casos de diarreia e problemas respiratórios. Já foi demonstrado experimentalmente, que a forma subclínica está associada à diminuição de eficácia das vacinas.
As lesões e os sinais clínicos causados pela infecção pelo PCV3 não estão totalmente elucidados, porém, parecem ser semelhantes aos causados pelo PCV2. Estudo recente reproduziu a Síndrome da Dermatite e Nefropatia suína, em animais de 4 a 8 semanas de idade, após inoculação do vírus pela via intranasal. Além disso, o material genético do PCV3 foi detectado em tecidos de animais com problemas gastrointestinais, respiratórios, reprodutivos, doença multissistêmica, sinais clínicos neurológicos e em animais sadios. O vírus foi descrito em co-infecção com PCV2, vírus da síndrome respiratória, reprodutiva suína (PRRS), Parvovirus suíno, entre outros.
A importância do diagnóstico
O circovírus suíno é um agente distribuído mundialmente, e após a introdução das vacinas na suinocultura a carga viral presente nos animais se tornou baixa, porém os suínos permanecem infectados por um longo período de tempo. Desta forma, para um diagnóstico preciso, além da detecção do agente é necessário associar quadro clínico, lesões macroscópicas e microscópicas (histopatológico). A detecção do vírus é realizada a partir de técnicas moleculares, como Reação em Cadeia da Polimerase (PCR). A sorologia para o circovírus permite monitorar o rebanho, não é ferramenta diagnóstica para doença clínica.
Os sinais clínicos e lesões variam conforme a síndrome ou quadro clínico que o animal estiver apresentando. De modo geral os principais órgãos acometidos na circovirose suína são os rins, pulmões e fígado. A linfadenomegalia ocorre com maior ou menor intensidade nos casos de SMDS. Histologicamente pode-se observar infiltrado inflamatório linfo-histiocítico, associado ou não, a células gigantes multinucleadas e corpúsculos de inclusão intracitoplasmáticos.
O PCV3 por sua vez, também é encontrado associado a diferentes sinais clínicos, porém, mais estudos são necessários para o entendimento da patogenia e lesões macro e microscópicas causadas pelo agente. Em comparação ao PCV2, a depleção linfóide não é uma característica da infecção por PCV3.
Para coleta e envio de amostras suspeitas de circovirose, os seguintes órgãos devem ser remetidos ao laboratório: linfonodos, pulmão, coração, rins, fígado, fragmentos de pele, caso haja lesão. Pode-se ainda enviar natimortos e fetos abortados, nos casos de falhas reprodutivas. O material deve ser enviado refrigerado e fragmentos de órgãos devem sem enviados em formol a 10%.
Controle e vacinação
A circovirose suína é considerada uma doença multifatorial, consequentemente, para controle efetivo da enfermidade é necessário identificar e eliminar os fatores de risco, controlar as co-infecções, intensificar estratégias de manejo e realizar a vacinação do plantel. No Brasil há cinco vacinas comerciais, sendo que três delas são somente contra o PCV2a, uma contra o PCV2b e uma contra PCV2a e PCV2b. Não há vacinas comerciais disponíveis para os demais genótipos, tampouco para o PCV3, e a imunidade cruzada não está comprovada entre os subtipos.
Apesar da implementação da vacinação no Brasil ter sido excepcional para a diminuição da prevalência e viremia da circovirose suína nos plantéis, com o surgimento de genótipos mais patogênicos, e que são antigenicamente e geneticamente diferentes entre si, a atualização das vacinas se faz necessária. E mesmo que haja escassez de informações sobre as implicações clínicas do PCV3, o mesmo não deve ser negligenciado, levando em consideração que a doença já foi reproduzida experimentalmente, além de fazer parte da mesma família do PCV2.
Desta forma, a utilização de vacinas autógenas, com cepas específicas de cada granja, se torna uma ferramenta importante e essencial para controle da enfermidade, assim como para evitar possíveis “escapes imunológicos” e falhas vacinais.
A INATA é a primeira empresa brasileira produzir vacinas autógenas virais, como Influenza suína, (H1N1, H1N1pdm, H1N2 e H3N2) Rotavírus A, (testes com Rotavírus B, C e H) e iniciando testes para vacinas autógenas combinadas para PCV2 A, B e D e PCV3.
Quer conhecer melhor a vacina autógena? Ver como ela ajuda os suínos a se manterem saudáveis? Entre em contato com a Inata Produtos Biológicos e veja como esse produto personalizado ajudará na proteção da sua granja, a partir de agentes patogênicos virais e bacterianos isolados na sua propriedade!
Referências
Segalés, J. Porcine circovirus type 2 (PCV2)infections: clinical signs, pathology and laboratory diagnosis. Virus Research. 164:10-9. 35, 2012.
Klaumann, F. et al. Current Knowledge on Porcine circovirus 3 (PCV-3): a novel vírus with a yet Unknown impacto n the swine industry. Frontiers in Veterinary Science. 5:315, 2018.
Tochetto C, Lima DA, Varela APM, Loiko MR, Paim WP, Scheffer CM, et al. Full-Genome Sequence of Porcine Circovirus type 3 recovered from serum of sows with stillbirths in Brazil. Transbound Emerg Dis. 65:5–9, 2017.
Panzardi, A. et al. Caracterização e dinâmica de evolução dos diferentes genótipos de circovírus no Brasil ao longo dos anos de 2003 a 2018. Avanços em sanidade, produção e reprodução de suínos – IV Anais do XII SINSUI-Simpósio Internacional de Suinocultura. 2019. Disponível em: https://www.conferencebr.com/conteudo/arquivo/anais-sinsui-2019-1566829787.pdf . Acesso em 30/10/2019.
Ssemadaali, M.A.; Ilha, M. & Ramamoorthy, S. Genetic diversity of procine circovirus type 2 and implications for detection na control. Research in Veterinary Science, v.103, p.179-186, 2015.
Piñeyro, P. et al. Porcine circovirus 3: A new member of the PCVAD complex? Disponível em: https://www.nationalhogfarmer.com/animal-health/porcine-circovirus-3-new-member-pcvad-complex
Fux, R. et al. Full genome characterization of porcine circovirus type 3 isolates reveals the existence of two distinct groups of virus strains. Virology Journal. v. 15:25, p. 2-9, 2018.
Phan, G.T. et al. Detection of a novel circovirus PCV3 in pigs with cardiac and multi-systemic inflammation. Virology Journal. v. 13:184, p.2-8, 2016.
Jiang, H. et al. Induction of porcine dermatitis and nephropathy syndrome in piglets by infection with porcine circovirus type 3. Journal of Virology. 2018.



